1. На основании термохимического уравнения окисления магния оксидом углерода (IV)
2Mg(тв.) + CO(г.) = 2MgO(тв.) + C(тв.) + 810,1 кДж
рассчитайте, какое количество теплоты выделится при окислении 36 г магния.
2. Некоторая реакция, отображаемая уравнением 2A + X = A2X, протекает в растворе. Исходная концентрация вещества A была равна 2 моль/л. Через 5 мин концентрация вещества A составляла 0,04 моль/л. Вычислите среднюю скорость данной реакции за указанный промежуток времени. Во сколько раз изменится концентрация вещества X за то же время?
3. Ниже приведены схемы некоторых реакций. Преобразуйте эти схемы в уравнения обратимых реакций. Определите, в какую сторону сместится равновесие реакций при:
а) повышении температуры; б) понижении давления.
3Fe(тв.) + 4H2O(г.) ⟶ Fe3O4(тв.) + 4H2(г.) + Q
2PbO2(тв.) ⟶ 2PbO(тв.) + O2(г.) — Q
4. Подберите факторы, изменяя которые можно добиться увеличения выхода оксида серы (VI) в ходе окисления оксида серы (IV) кислородом:
2SO2(г.) + O(г.) ⇄ SO3(г.)
Ответ:

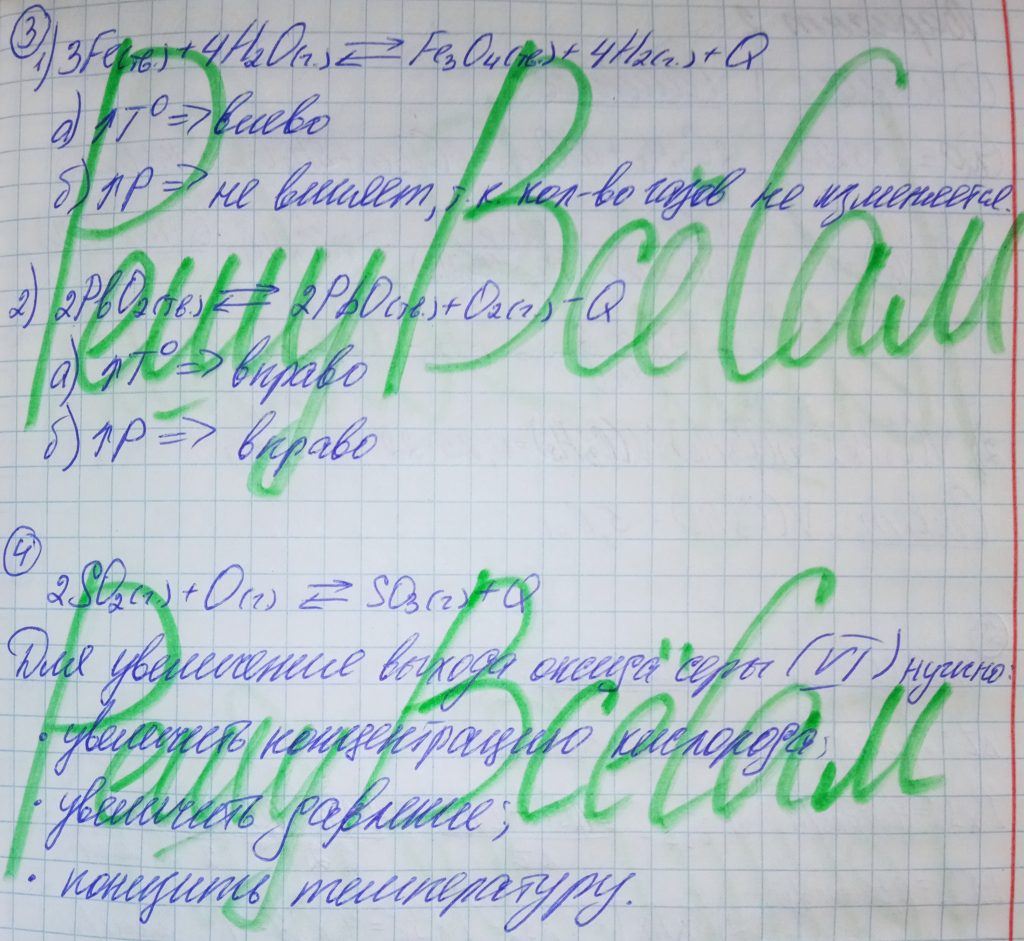
Контрольная работа по теме «Теоретические основы химических процессов».
