1. На основании термохимического уравнения горения пропана (C3H8, г.)
2C3H8(г.) + 10O2(г.) = 6CO2(г.) + 8H2O(ж.) + 4440 кДж
рассчитайте, какой объем (н. у.) пропана сожгли, если в результате реакции выделилось 555 кДж теплоты.
2. Некоторая реакция, отображаемая уравнением A + 2X = AX2, протекает в растворе. Исходная концентрация вещества X была равна 4 моль/л. Через 2 мин концентрация вещества A составляла 0,5 моль/л. Вычислите среднюю скорость данной реакции за указанный промежуток времени. Во сколько раз изменится концентрация вещества A за то же время?
3. Ниже приведены схемы некоторых реакций. Преобразуйте эти схемы в уравнения обратимых реакций. Определите, в какую сторону сместится равновесие реакций при:
а) повышении температуры; б) понижении давления.
CH4(г.) + H2O(г.) ⟶ CO2(г.) + H2(г.) — Q
MgCO3(тв.) ⟶ MgO(тв.) + CO2(г.) — Q
4. Подберите факторы, изменяя которые можно добиться увеличения выхода аммиака в реакции его синтеза из простых веществ: N2(г.) + 3H2(г.) ⇄ 2NH3(г.)
Ответ:

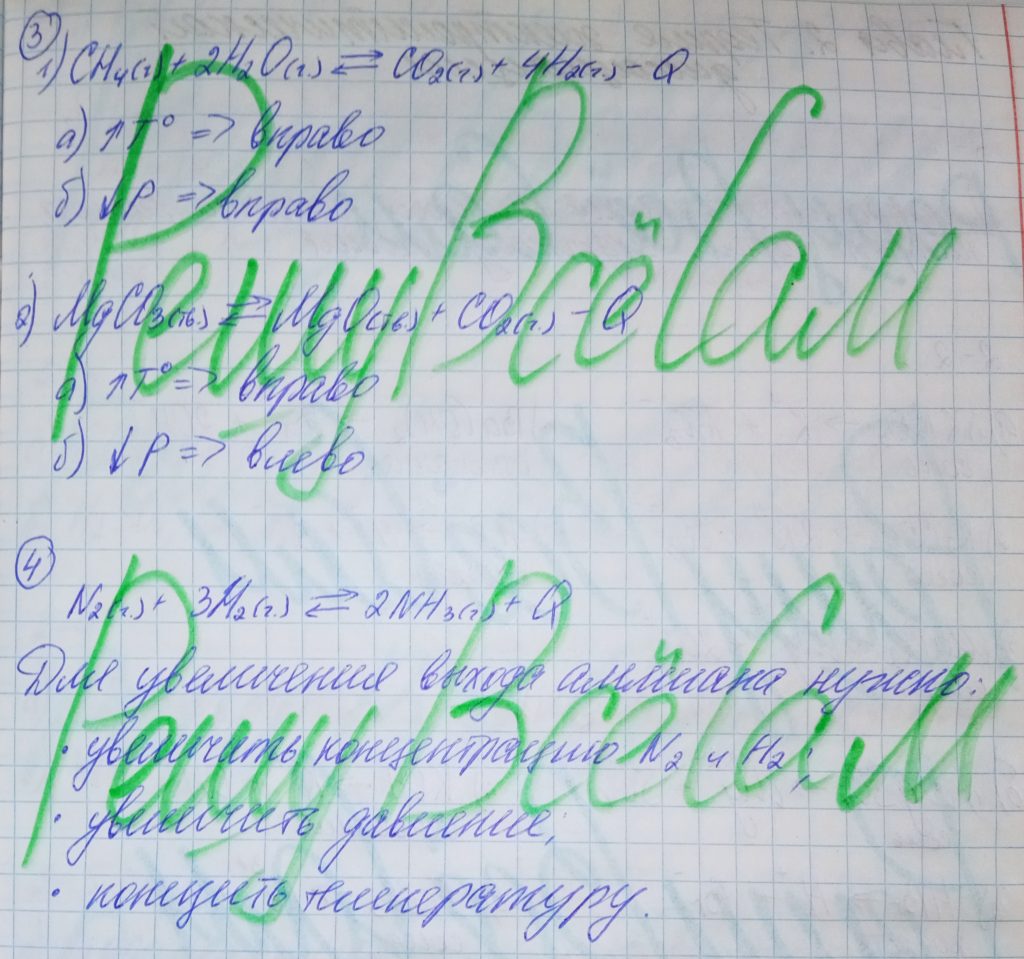
Контрольная работа по теме «Теоретические основы химических процессов».
